Secciones
Servicios
Destacamos
Secciones
Servicios
Destacamos
La comunidad científica no quiere oír hablar de cobayas humanas. Ni siquiera de conejillos de indias. Los ensayos con personas de nuevos tratamientos farmacológicos se ejecutan bajo estrictos protocolos de seguridad y sometidos a una rígida normativa internacional, enfatizan. Sin embargo, el riesgo cero no existe. Los últimos en demostrar que, pese al estrecho control que ejercen las autoridades sanitarias sobre estos esos test, no están libres de padecer en sus carnes reacciones adversas a esos compuestos en construcción están siendo los voluntarios de las vacunas contra el coronavirus.
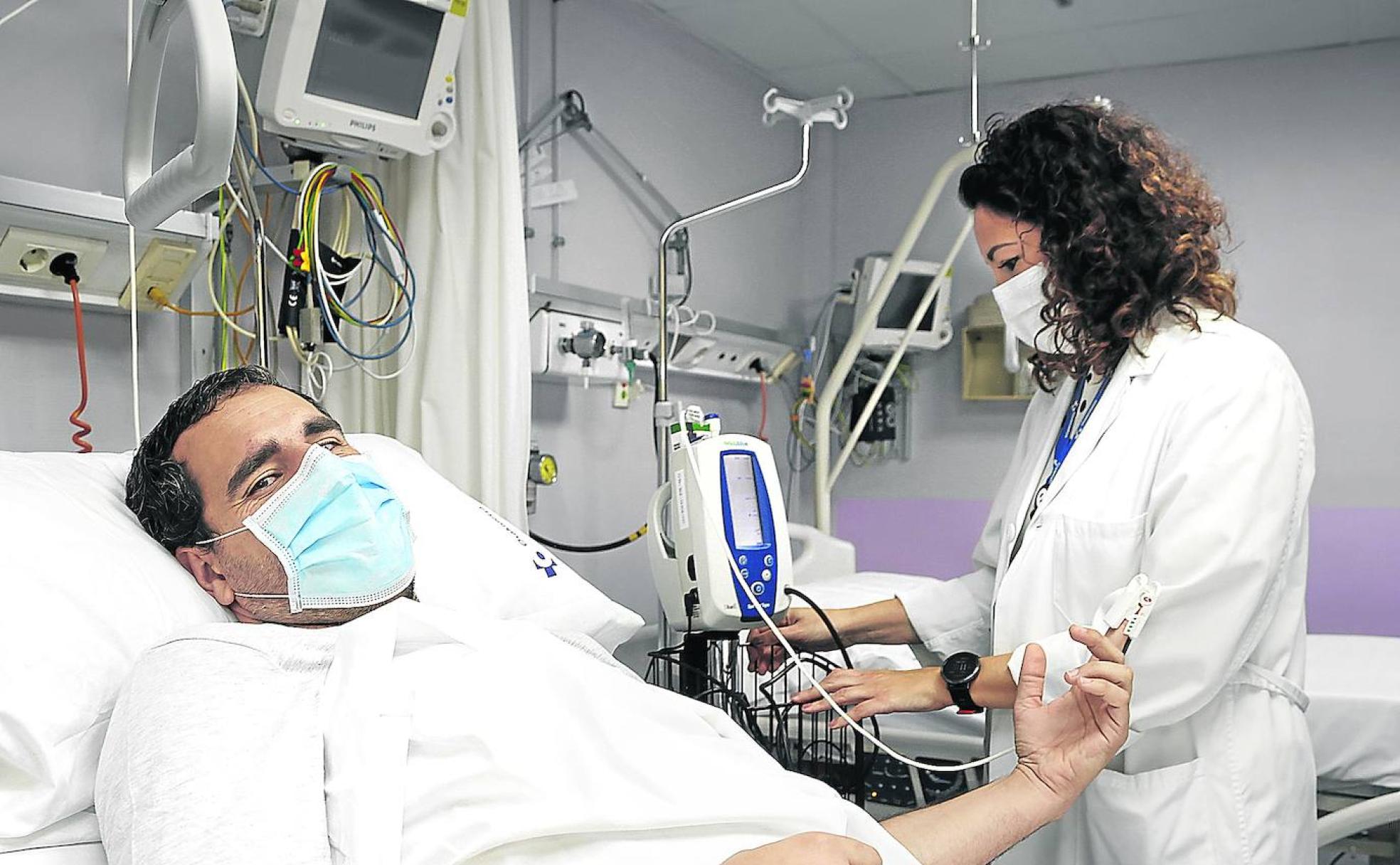
Incapaz de seguir de brazos cruzados ante la emergencia sanitaria mundial, Diego Bellido forma parte del batallón de 150 valientes que se ha dejado inyectar en España el prototipo del laboratorio Janssen (que trabaja para Johnson&Johson). No tardó en notar que algo potente corría por sus venas. «Estaba bien hasta que llegué a casa. Entonces se me empezó a disparar la fiebre. Ha sido duro. Pasé dos días hecho polvo», ha contado tras el primer asalto de un aventura que durará en principio un año, aunque ahora el experimento está parado por la enfermedad surgida en uno de estos voluntarios. En Inglaterra, Joan Pons, un enfermero español erradicado allí que se prestó a participar en el ensayo que lidera la Universidad de Oxford, ha resultado contagiado. Se encuentra bien, pero todavía desconoce si le inocularon el virus o un placebo.
Por ahora, los humanos seguimos siendo parte esencial del desarrollo de medicinas y vacunas. Ningún medicamento puede ser comercializado si previamente no se ha realizado un ensayo con una muestra de población representativa, en donde se compruebe que el compuesto funciona y que no representa un peligro para nuestra salud. Antes, eso sí, el compuesto debe superar con éxito varias metas volantes: la prueba de despegue, que se efectúa 'in vitro' con células, el test siguiente con ratas, ratones o conejos y, por último, el ensayo con perros o monos. Solo entonces, y previa autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), dependiente del Ministerio de Sanidad, arrancarán las pruebas en humanos.
El informático vitoriano Alberto Geijo, 35 años, está como un roble, pero ha pasado ingresado varios días de manera intermitente en los últimos diez años para someterse como voluntario a siete ensayos clínicos coordinados por el instituto público de investigación sanitaria Bioaraba, una de las veinte unidades de fase 1 que hay en España. Ha probado varios broncodilatadores, antiinflamatorios, protectores gástricos... No se anda por las ramas: «Mi motivación es puramente económica. Es una manera sencilla de salir de un apuro». Debutó en su etapa de estudiante presentándose a un proceso de selección por recomendación de una amiga. Lo hizo con «mil millones de dudas, pero siempre me he sentido cuidado e informado de lo que va a pasar y puede ocurrir. A menudo quieren comprobar la absorción de los medicamentos y te aplican dosis mínimas. Nunca me he sentido en riesgo ni he tenido efectos secundarios».
Tras varios años desvinculado de los ensayos, ahora que la crisis le ha dejado sin trabajo, Geijo ha vuelto a ofrecerse voluntario.
- ¿Ejercería como probeta humana para un ensayo sobre la Covid?
- Eso me parece más arriesgado. Necesitaría unas garantías de seguridad y una remuneración altas, y también pasar por un gran aprieto económico.
Este año, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha dado luz verde a 782 ensayos clínicos -124 de ellos dirigidos a plantar cara a la Covid-, lo que nos convierte en una potencia mundial en investigación biomédica. «España es el país al que más multinacionales farmacéuticas vienen a realizar sus ensayos, por detrás solo de los Estados Unidos. Hay varias razones, como la calidad de nuestra comunidad científica y el hecho de que la investigación forma parte de la asistencia médica. Otro elemento clave es nuestra legislación. Somos el primer país de Europa que implementó la nueva regulación -lo hizo en 2016-, y que simplifica y agiliza los procedimientos y reduce la burocracia», explica Amelia Martín Uranga, responsable de la Plataforma de Medicamentos Innovadores de Farmaindustria.
En la actualidad, unos 120.000 españoles participan en alguno de los 782 ensayos clínicos en curso. Teniendo en cuenta que esta etapa puede prolongarse durante tres años, la media de personas implicadas en los procesos se sitúa en 40.000 al año. La amplia mayoría son pacientes con pronósticos desesperanzadores. El resto, personas sanas. Ambas resultan imprescindibles para acometer estos estudios.



Los ensayos clínicos arrancan a menudo con voluntarios que no presentan ninguna patología y que, por tanto, se encuentran en mejores condiciones para afrontar los posibles efectos adversos del compuesto. En una segunda fase se administra a personas que padecen la enfermedad que se pretende tratar y los efectos del fármaco se contrastan con un placebo, una sustancia inocua y sin efecto. En la tercera y última se aplica a un número mayor de enfermos y se compara su eficacia con la del medicamento más competente disponible, si lo hay.
Modesto Alcolea conoce bien los protocolos que guían los ensayos clínicos. Participó en uno. Su médico se lo recomendó como el último tren para tratar de salvar su vida. Todo comenzó un día de 2009, cuando descubrió que tenía una pequeña mancha en la espalda. La ignoró hasta que sangró. El dermatólogo lo vio claro. Era un melanoma. «Me intervinieron. El lunar solo tenía el tamaño de una lenteja, pero me pusieron entre 50 y 60 grapas». Creía superada la pesadilla, pero en realidad estaba por llegar. A los dos años empezó a sentirse mal. «Tenía fiebre a diario, pocas ganas de comer y unos dolores cada vez más intensos en el hombro. No tenía fuerzas». Una ecografía reveló un tumor en el hígado con metástasis en los pulmones.
«Desde bien joven trabajé en una excavadora, en el monte, expuesto a muchas horas de sol, sin camiseta y sin tener ningún cuidado. Nunca pensé lo que aquello me podría provocar». Los médicos no se anduvieron por las ramas. La quimioterapia no es eficaz contra los melanomas. No había solución para él; tan solo una minúscula y borrosa luz al final del pozo, a la que aferrarse. «Mi médico me dijo que la Clínica Universidad de Navarra -el centro privado español que más pruebas clínicas desarrolla- estaba ensayando un tratamiento traído de los Estados Unidos para tratar este tipo de cáncer y me recomendó que probara. Yo notaba que me iba apagando. Ya estaba en 55 kilos. Fui de cabeza».
Una vez allí le advirtieron de que sería un camino largo y de que necesitaría suerte y confianza. No exageraron. Durante seis años y medio, Alcolea se trasladó de Logroño a Pamplona cada quince días para que le aplicaran Nivolumad, inmunoterapia experimental en vena en sesiones de casi dos horas. Le previnieron de posibles efectos secundarios: fiebre, vómitos, picores... Nada que no conociera. En los dos primeros años no mejoró. Al contrario. El tumor creció y padeció cuatro abscesos hepáticos. «El hígado se llenaba de pus y había que drenarlo. Estuve muy mal. Más de una vez pensé que aquello se acababa».
En 2015 empezó a sentirse mejor, lo suficiente como para soportar una operación de once horas en la que le extirparon parte del hígado y del diafragma, y le limpiaron los pulmones. A primeros de 2017 le administraron la última dosis, la número 84. Estaba curado. «Éramos 70 u 80 en el ensayo. No sé qué ocurrió con los demás. Yo hoy hago vida normal. Ha sido un regalo de Dios. Me siento enormemente agradecido. Jamás habría podido pagarme este tratamiento» ¿La lección? «Hay que hacer caso a los médicos y confiar en la ciencia».
De que en España las pruebas discurran con todas las garantías para los voluntarios se encargan la AEMPS y los Comités de Ética de Investigación con Medicamentos, cuyo plácet también resulta indispensable para que se lleve a cabo un ensayo clínico. Hay un centenar acreditados y son de carácter multidisciplinar, de manera que están integrados por médicos, farmacólogos y abogados, además de por un representante de los pacientes.
Amelia Martín Uranga, responsable de la Plataforma de Medicamentos Innovadores de Farmaindustria, se queja de que esta destacada actividad investigadora contrasta con una «escasa cultura científica en nuestra sociedad, que hace que en ocasiones se hable de cobayas humanas con absoluto desconocimiento». La responsable de la patronal del sector admite que «el riesgo cero no existe. Ni aquí ni en nada. Pero son procesos extraordinariamente vigilados y seguros. Por supuesto, todos los participantes están asegurados», recalca.
«Pese a que 25 millones de españoles toman a diario al menos un medicamento, pocos saben que detrás de un nuevo fármaco hay una inversión media de 2.500 millones de euros y entre 10 y 12 años de estudios y pruebas. De las 10.000 moléculas que entran en las primeras fases de desarrollo del medicamento, solo una se llega a comercializar», recuerda Martín Uranga.
El Hospital San Joan de Déu, en Barcelona, es el único centro sanitario pediátrico de España con una unidad de investigación. En la actualidad tiene en marcha 165 ensayos clínicos en los que participan medio millar de pacientes de 0 a 18 años. Todo enfermos. Hasta los 12, los padres o tutores se encargan de firmar el consentimiento informado. A partir de esa edad, los niños deben estampar su rúbrica en un documento de 16 páginas de asentimiento, donde se les explican los riesgos y beneficios del ensayo. A menudo les resulta complejo de entender. Tanto que un grupo de pacientes de ese hospital ha elaborado una guía sobre cómo debe presentarse ese documento. Entre sus demandas, piden que se incluyan dibujos, que no les llame 'sujetos' y que no aparezca la palabra muerte.
Publicidad
José Antonio Guerrero | Madrid y Álex Sánchez
Mateo Balín y Sara I. Belled (gráficos)
Esta funcionalidad es exclusiva para registrados.
Reporta un error en esta noticia

Comentar es una ventaja exclusiva para registrados
¿Ya eres registrado?
Inicia sesiónNecesitas ser suscriptor para poder votar.